Cơ quan quản lý dược phẩm Ấn Độ đang lên danh sách các công ty dược phẩm sản xuất các loại siro ho tại tất cả các bang và vùng lãnh thổ liên bang, để chuẩn bị cho cuộc thanh tra trên toàn quốc. Diễn biến này được đặt trong bối cảnh số trẻ em tử vong tại Ấn Độ do nghi ngờ uống phải siro có chứa chất độc đã tăng lên 24. Theo đó, Tổ chức Kiểm soát Tiêu chuẩn Dược phẩm Trung ương (CDSCO) Ấn Độ sẽ tiến hành thử nghiệm, thanh tra và kiểm toán các nhà sản xuất siro ho. Cơ quan này cũng đã gửi thư cho Tổ chức Y tế Thế giới (WHO) thông báo về sự hiện diện của các chất gây ô nhiễm độc hại trong ít nhất ba loại siro ho. 24 trẻ em tại quận Chhindwara, bang Madhya Pradesh, miền Trung Ấn Độ đã tử vong sau khi uống các sản phẩm này.
Bộ Y tế Ấn Độ trước đó xác nhận một lô thuốc ho Coldrif, do công ty dược Sresan Pharma có trụ sở tại bang miền Nam Tamil Nadu sản xuất, chứa 48% Diethylene Glycol (DEG). Hai loại siro khác được sản xuất tại bang miền Tây Gujarat là Respifresh TR và Relife, cũng được phát hiện có nồng độ chất này cao hơn mức giới hạn quy định. Diethylene Glycol là một hóa chất công nghiệp rẻ tiền và không màu, thường được sử dụng trong sản xuất các sản phẩm như dầu phanh và sơn. Chất này đôi khi có thể bị sử dụng nhầm lẫn hoặc bất hợp pháp trong y tế để thay thế cho chất Propylene Glycol (một dung môi giúp hòa tan thuốc thành dạng lỏng). Các nguồn tin cho biết tới thời điểm này, chưa có lô hàng nào trong số ba loại siro này của Ấn Độ được xuất khẩu ra bên ngoài. Cơ quan quản lý dược phẩm trung ương cũng đã yêu cầu Cục Quản lý Thực phẩm và Dược phẩm bang Tamil Nadu (FDA) giải thích lý do tại sao việc thử nghiệm sản phẩm và kiểm tra không được thực hiện tại các cơ sở của Sresan Pharma.
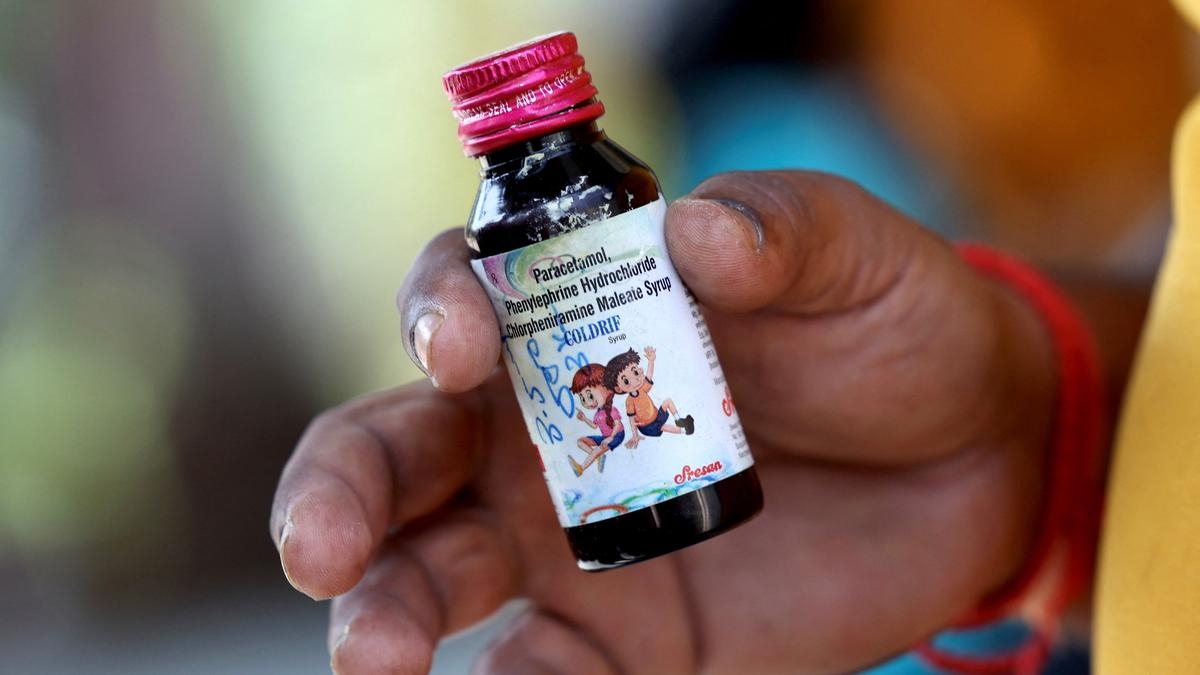
Một cuộc kiểm tra được thực hiện sau sự cố gần đây ghi nhận 364 lỗi và vi phạm liên quan tới nhà sản xuất này, trong đó có 38 trường hợp rất nghiêm trọng. Sresan Pharma đã được cấp giấy phép vào năm 2011, và được nhà chức trách bang Tamil Nadu gia hạn vào năm 2016-2017, mà không thông báo cho CDSCO. CDSCO đã khuyến nghị hủy giấy phép và khởi xướng điều tra hình sự đối với công ty này. Trường hợp của một nhà sản xuất khác tại bang Gujarat cũng đang được xem xét.
Hôm 8/10, Tổng cục Kiểm soát Dược phẩm Ấn Độ (DCGI) đã yêu cầu tất cả các bang phải đảm bảo việc kiểm tra nguyên liệu thô và công thức thành phẩm của các sản phẩm dược phẩm trước khi đưa ra thị trường. Trong thông báo, cơ quan này cho biết trong các cuộc thanh tra gần đây tại các cơ sở sản xuất và trong quá trình điều tra, người ta phát hiện ra rằng một số nhà sản xuất không kiểm tra từng lô tá dược và hoạt chất để đảm bảo tuân thủ các tiêu chuẩn quy định trước khi sử dụng.
Bên cạnh đó, Tổng cục Dịch vụ Y tế (DGHS) Ấn Độ cũng đã chỉ đạo các địa phương đảm bảo siro ho không được kê đơn hoặc sử dụng cho trẻ em dưới 5 tuổi.
Ấn Độ từng vướng phải các rắc rối liên quan tới các loại siro ho thời gian gần đây. Năm 2022, WHO đã ban hành cảnh báo sau khi siro ho do Ấn Độ sản xuất có liên quan đến cái chết của trẻ em ở Uzbekistan và Gambia. Các xét nghiệm sau đó xác nhận sự hiện diện của chất gây chết người trong các sản phẩm này./.
Phan Tùng/ VOV Ấn Độ
Bình luận